Vídeos relacionados:
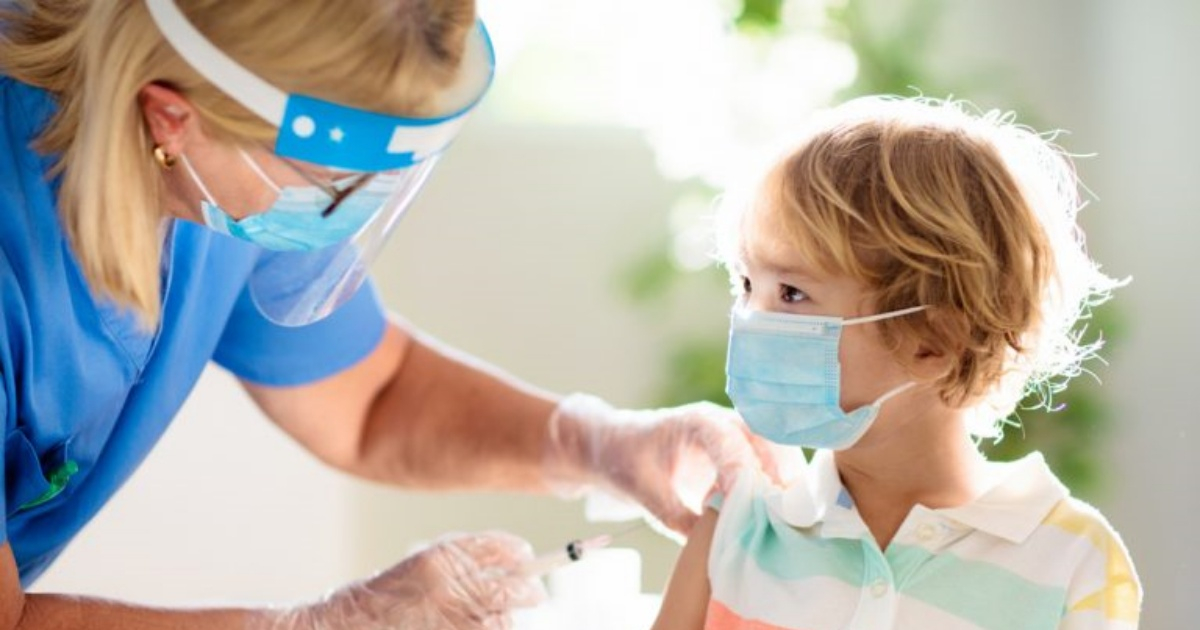
WASHINGTON, 7 oct (Reuters) - Pfizer Inc y BioNTech han pedido a los reguladores de Estados Unidos que aprueben el uso de emergencia de su vacuna contra el COVID-19 para niños de cinco a 11 años, dijo la empresa estadounidense en su cuenta de Twitter.
La solicitud a la Administración de Fármacos y Alimentos de Estados Unidos se produce cuando las infecciones por COVID-19 se han disparado en los niños, alcanzando su punto más alto en la pandemia a principios de septiembre, según datos de la Academia Estadounidense de Pediatría.
Lo más leído hoy:
La FDA ha fijado el 26 de octubre para que los asesores externos se reúnan y discutan la solicitud de Pfizer, lo que permitirá que los niños comiencen a recibir las vacunas poco después.
Una autorización rápida podría ayudar a mitigar un posible aumento de casos este otoño boreal, con las escuelas abiertas en todo el país.
Se ha demostrado que la vacuna, que ya está autorizada en niños de 12 a 15 años y totalmente aprobada para mayores de 16 años, induce una fuerte respuesta inmune en el grupo de edad de 5 a 11 años, según dijeron ambas compañías el 20 de septiembre, refiriendo un ensayo clínico de 2.268 participantes.
La vacuna Pfizer-BioNTech se aprobó para uso en niños de entre 12 y 15 años aproximadamente un mes después de que las empresas solicitaran la autorización.
Si bien los niños son menos susceptibles al COVID-19 grave, pueden transmitir el virus a otras personas, incluidas las poblaciones vulnerables que corren un mayor riesgo de contraer una enfermedad severa.
(Reporte de Susan Heavey, Manas Mishra; Editado en español por Gabriela Donoso)
Archivado en: