Vídeos relacionados:
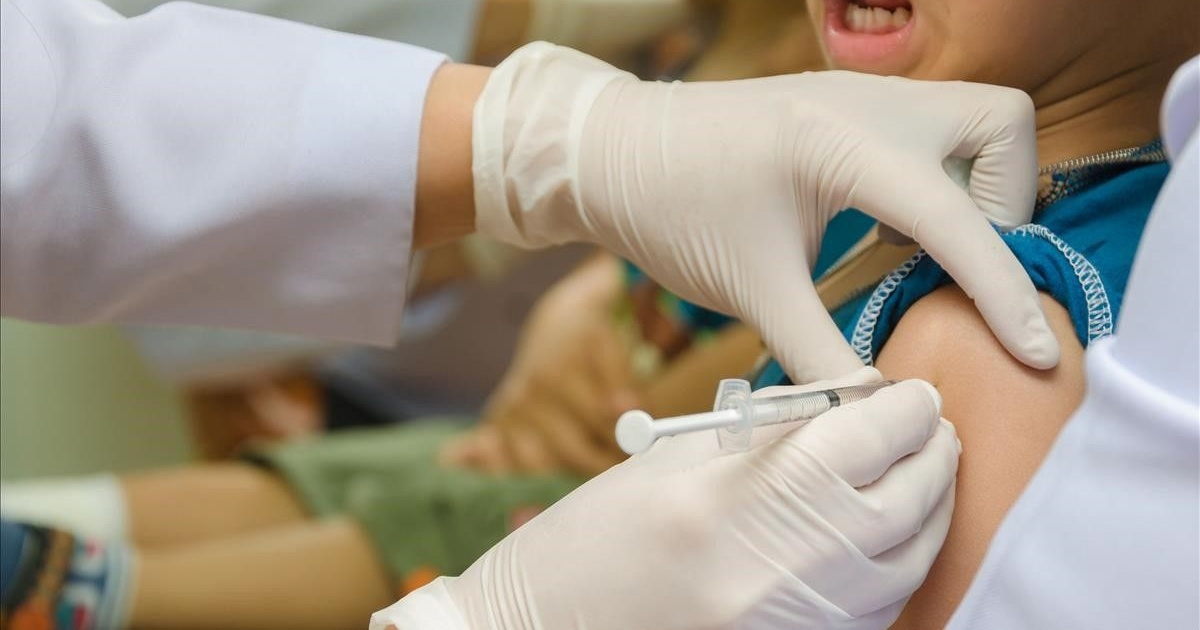
20 sep (Reuters) - Pfizer y BioNTech dijeron este lunes que su vacuna contra el coronavirus indujo una sólida respuesta inmune en niños de 5 a 11 años, y planean pedir autorización para usarla los antes posible en menores de ese rango de edad en Estados Unidos, Europa y otros lugares.
Las compañías afirmaron que la vacuna generó una respuesta inmune en niños de 5 a 11 años en su ensayo clínico de Fase II/III que coincidió con lo que habían observado previamente en personas de 16 a 25 años. El perfil de seguridad también en general comparable al del grupo de mayor edad, dijeron.
Lo más leído hoy:
"Desde julio, los casos pediátricos de COVID-19 han aumentado en aproximadamente un 240 por ciento en Estados Unidos, lo que subraya la necesidad de vacunación para la salud pública", declaró el presidente ejecutivo de Pfizer, Albert Bourla, en un comunicado de prensa.
"Los resultados de estos ensayos proporcionan una base sólida para buscar la autorización de nuestra vacuna para niños de 5 a 11 años, y planeamos enviarlos a la FDA y otros reguladores con urgencia".
Las hospitalizaciones y muertes por COVID-19 han aumentado en Estados Unidos en los últimos meses debido a la variante Delta. Los casos pediátricos también han crecido, sobre todo porque los niños menores de 12 años no están vacunados, pero no hay indicios de que, además de ser más contagioso, Delta sea más peligrosa en los niños.
Una autorización rápida podría ayudar a mitigar un posible aumento de casos en el otoño boreal, especialmente con las escuelas que ya están abiertas en todo el país.
A diferencia del ensayo clínico más grande que los fabricantes realizaron anteriormente en adultos, el ensayo pediátrico con 2.268 participantes no fue diseñado principalmente para medir la eficacia de la vacuna comparando el número de casos de COVID-19 en los receptores de la vacuna con los que recibieron un placebo.
En cambio, el ensayo compara la cantidad de anticuerpos neutralizantes inducidos por la vacuna en los niños con la respuesta de los receptores mayores en el ensayo de adultos.
Un portavoz de Pfizer dijo que las empresas podrían revelar más tarde la eficacia de la vacuna del ensayo, pero aún no ha habido suficientes casos de COVID-19 entre los participantes para tomar esa determinación.
La vacuna tuvo una efectividad de alrededor del 95 por ciento en el ensayo clínico de adultos, pero Pfizer ha señalado que la inmunidad disminuye algunos meses después de la segunda dosis. Se espera que los reguladores estadounidenses autoricen una tercera dosis de refuerzo para los estadounidenses mayores y de alto riesgo a principios de esta semana.
Los reguladores han relacionado las vacunas Pfizer y Moderna con casos raros de inflamación cardíaca en adolescentes y adultos jóvenes, particularmente en hombres jóvenes. Pfizer dijo que no vieron ningún caso de miocarditis en los participantes del ensayo.
(Reporte de Michael Erman; Editado en español por Janisse Huambachano)
Archivado en: