Vídeos relacionados:
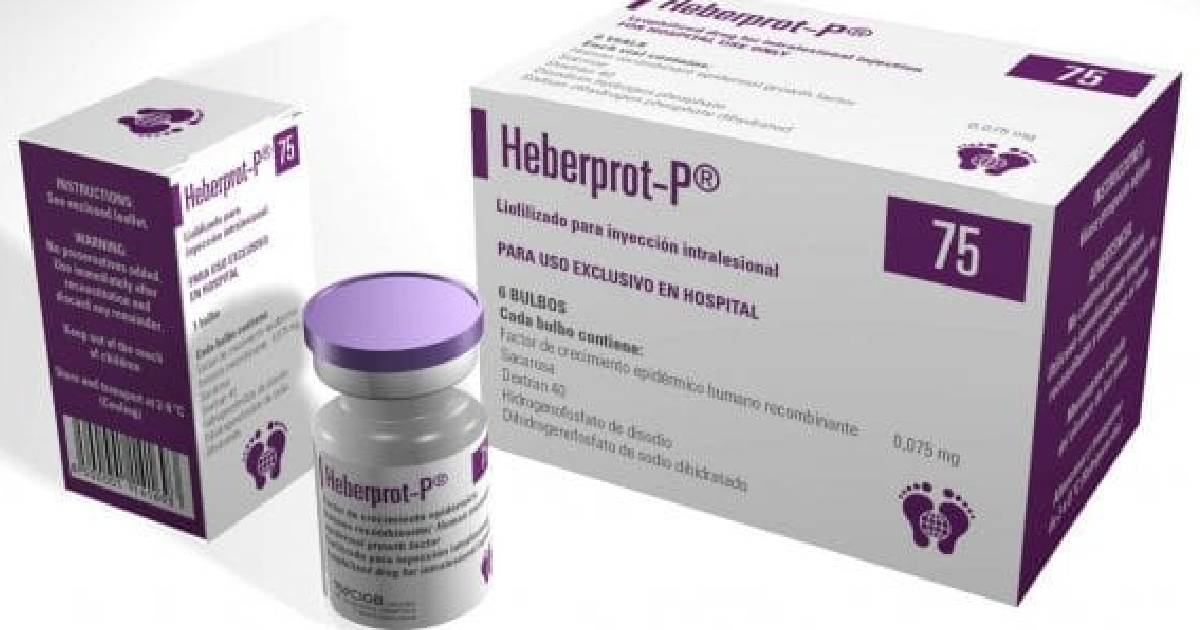
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) emitió una autorización para la realización de un ensayo clínico con el medicamento cubano Heberprot-P.
La compañía estadounidense Discovery Therapeutics Caribe (DTC), especializada en biotecnología, anunció que en el primer trimestre de 2024, presentó ante esa entidad federal una solicitud de nuevo medicamento en investigación (IND) para el factor de crecimiento epidérmico humano recombinante intralesional (rhEGF) producido por el régimen cubano.
Lo más leído hoy:
Este medicamento está destinado al tratamiento de úlceras complejas, una de las complicaciones más graves de la diabetes, explicó por su parte el grupo cubano de la industria farmacéutica BioCubaFarma, en una comunicado de Facebook.
La FDA revisó la solicitud y concedió a DTC la autorización para continuar con su investigación clínica de Fase 3, lo que marca un paso significativo hacia el inicio del ensayo, señaló la empresa.
Según el régimen cubano el Heberprot-P –producido por el Centro de Ingeniería Genética y Biotecnología (CIGB)– es reconocido internacionalmente y cuenta con estudios de fármacovigilancia durante 16 años.
"Desde su autorización de comercialización en 2006, se estima que más de 400,000 pacientes en todo el mundo han sido tratados con Heberprot-P para úlceras del pie diabético (UPD)", expresa el comunicado.
El comunicado publicado por BioCubaFarma cita que el Dr. David Armstrong, destacado cirujano pediátrico de la Universidad del Sur de California y experto en úlceras de pie diabético, resaltó la urgente necesidad de terapias innovadoras para detener la progresión de las ulceraciones en pacientes diabéticos.
El ensayo de fase 3 en Estados Unidos evaluará la eficacia del Heberprot-P en pacientes con UPD y representa una oportunidad emocionante para mejorar el tratamiento de esta afección, subrayó.
En 2017 el medicamento llegó al mercado europeo, a Rusia y a países latinoamericanos.
Archivado en: